
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
Սահմանափակում -ից Դալթոնի օրենքը
Այն օրենք լավ է պահում իրական գազերի համար ցածր ճնշման դեպքում, բայց բարձր ճնշման դեպքում այն զգալիորեն շեղվում է: Գազերի խառնուրդն իր բնույթով ոչ ռեակտիվ է։ Ենթադրվում է նաև, որ յուրաքանչյուր առանձին գազի մոլեկուլների միջև փոխազդեցությունը նույնն է, ինչ խառնուրդի մոլեկուլները:
Այս կերպ ի՞նչ է սահմանում Դալթոնի օրենքը։
Քիմիայի և ֆիզիկայի մեջ, Դալթոնի օրենքը (Կոչվում է նաեւ Դալթոնի օրենքը մասնակի ճնշում) պետությունները որ չհակազդող գազերի խառնուրդում գործադրվող ընդհանուր ճնշումը է հավասար է առանձին գազերի մասնակի ճնշումների գումարին։
Բացի վերը նշվածից, ինչու է Դալթոնի օրենքը կարևոր: Դալթոնի օրենքը հատկապես է կարևոր մթնոլորտային ուսումնասիրություններում։ Մթնոլորտը հիմնականում կազմված է ազոտից, թթվածնից, ածխաթթու գազից և ջրային գոլորշիներից. ընդհանուր մթնոլորտային ճնշումը յուրաքանչյուր գազի մասնակի ճնշման գումարն է: Դալթոնի օրենքը մեծ դեր է խաղում բժշկության և շնչառական այլ ոլորտներում:
Հետո ի՞նչն է հաստատուն մնում Դալթոնի օրենքում:
Կրկին հիմնվելով գազերի և իդեալական գազի կինետիկ տեսության վրա օրենք , Դալթոնի օրենքը կարող է կիրառվել նաև մոլերի քանակի վրա, որպեսզի մոլերի ընդհանուր թիվը հավասար լինի առանձին գազերի մոլերի քանակի գումարին: Այստեղ ճնշումը, ջերմաստիճանը և ծավալը պահվում են մշտական համակարգում։
Ինչպե՞ս Դալթոնը հայտնաբերեց մասնակի ճնշման օրենքը:
Դալթոնի օրենքը Դալթոնի օրենքը գազերի վրա կատարած փորձերը հանգեցրին նրա բացահայտմանը, որ ընդհանուր ճնշում գազերի խառնուրդի գումարը կազմել է մասնակի ճնշումներ որ յուրաքանչյուր առանձին գազ գործադրել է նույն տարածքը զբաղեցնելիս։ 1803 թվականին այս գիտական սկզբունքը պաշտոնապես հայտնի դարձավ որպես Դալթոնի մասնակի ճնշման օրենքը.
Խորհուրդ ենք տալիս:
Ո՞րն է Ջոն Դալթոնի հայտնագործությունը:

Ջոն Դալթոն (/ˈd?ːlt?n/; սեպտեմբերի 6, 1766 – հուլիսի 27, 1844) անգլիացի քիմիկոս, ֆիզիկոս և օդերևութաբան էր։ Նա առավել հայտնի է ատոմային տեսությունը քիմիայի մեջ մտցնելով և դալտոնիզմի վերաբերյալ իր հետազոտություններով, որոնք երբեմն նրա պատվին կոչվում են դալտոնիզմ:
Ի՞նչ է նշանակում խտությունից կախված սահմանափակող գործոն:
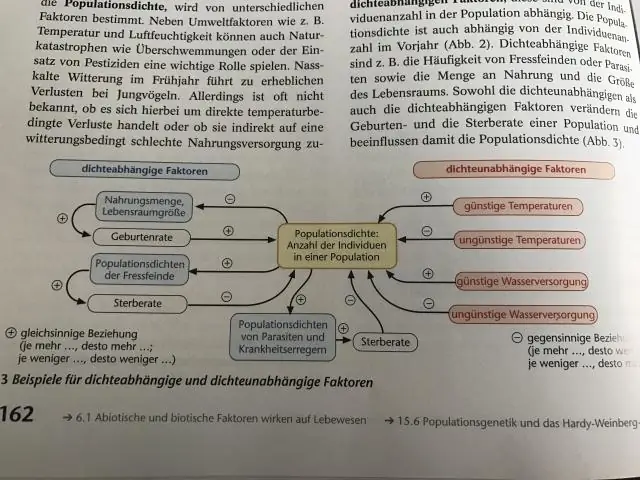
Խտությունից կախված սահմանափակող գործոններ Խտությունից կախված գործոններն այն գործոններն են, որոնց ազդեցությունը բնակչության չափի կամ աճի վրա տարբերվում է բնակչության խտությունից: Գոյություն ունեն խտությունից կախված սահմանափակող գործոնների բազմաթիվ տեսակներ, ինչպիսիք են. սննդի առկայությունը, գիշատիչ հիվանդությունները և միգրացիան
Ո՞վ է հայտնաբերել Դալթոնի օրենքը:

Ջոն Դալթոն
Ի՞նչ նկատի ունեք գծային շարժման պահպանման օրենք ասելով:

Պահպանման օրենքներ Պահպանման իրավունքում. Գծային իմպուլսի պահպանումն արտահայտում է այն փաստը, որ շարժման մեջ գտնվող մարմինը կամ մարմինների համակարգը պահպանում է իր ընդհանուր իմպուլսը, զանգվածի և վեկտորի արագության արտադրյալը, եթե դրա վրա արտաքին ուժ չի կիրառվում։ Մեկուսացված համակարգում (օրինակ՝ տիեզերքը) կան
Ինչու է լույսի ինտենսիվությունը սահմանափակող գործոն ֆոտոսինթեզի մեջ:

Լույսի ինտենսիվությունը Առանց բավարար լույսի, բույսը չի կարող շատ արագ ֆոտոսինթեզ կատարել, նույնիսկ եթե կա շատ ջուր և ածխաթթու գազ և համապատասխան ջերմաստիճան: Լույսի ինտենսիվության բարձրացումը մեծացնում է ֆոտոսինթեզի արագությունը, քանի դեռ որևէ այլ գործոն՝ սահմանափակող գործոն, դառնում է պակաս:
