- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
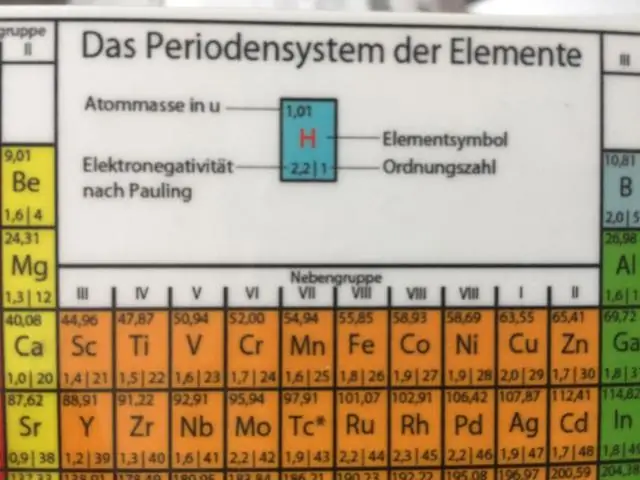
Իզոտոպներ որոշվում են սկզբում իրենց տարրով, այնուհետև առկա պրոտոնների և նեյտրոնների գումարով: Ածխածին-12 (կամ 12Գ) պարունակում է վեց պրոտոն, վեց նեյտրոն և վեց էլեկտրոն. հետևաբար, այն ունի 12 ամու զանգվածային թիվ (վեց պրոտոն և վեց նեյտրոն):
Այստեղ ինչպե՞ս է ձևավորվում իզոտոպը:
Իզոտոպներ նույն տարրի ատոմներն են, որոնք ունեն տարբեր թվով նեյտրոններ, բայց նույն թվով պրոտոններ և էլեկտրոններ: Ռադիոակտիվ (անկայուն) իզոտոպներ ունեն միջուկներ, որոնք ժամանակի ընթացքում ինքնաբերաբար քայքայվում են ձեւը այլ իզոտոպներ.
Երկրորդ, որո՞նք են իզոտոպների 3 օրինակները: Որոշ օրինակներ կայուն իզոտոպներ են իզոտոպներ ածխածնի, կալիումի, կալցիումի և վանադիումի. Ռադիոակտիվ իզոտոպներ ունեն պրոտոնների և նեյտրոնների անկայուն համակցություն, ուստի ունեն անկայուն միջուկներ։ Որովհետև սրանք իզոտոպներ անկայուն են, ենթարկվում են քայքայման և այդ ընթացքում կարող են արձակել ալֆա, բետա և գամմա ճառագայթներ։
Համապատասխանաբար, ի՞նչ է իզոտոպը և օրինակը։
-ի սահմանում Իզոտոպներ . Տարրերը որոշվում են ատոմային միջուկի պրոտոնների քանակով։ Համար օրինակ , 6 պրոտոն ունեցող ատոմը պետք է լինի ածխածին, իսկ 92 պրոտոն ունեցող ատոմը՝ ուրան։ Բացի պրոտոններից, գրեթե յուրաքանչյուր տարրի ատոմները պարունակում են նաև նեյտրոններ։
Ի՞նչ է իզոտոպի խորհրդանիշը:
Միջուկային խորհրդանիշ բաղկացած է երեք մասից խորհրդանիշ տարրի, տարրի ատոմային համարը և հատուկի զանգվածային թիվը իզոտոպ . Ահա միջուկայինի օրինակ խորհրդանիշ Տարրը խորհրդանիշ , Li, դա լիթիումի համար է: Ատոմի միջուկում պրոտոնների և նեյտրոնների թիվը.
Խորհուրդ ենք տալիս:
Ինչպե՞ս են իզոտոպները տարբերվում նույն տարրի միջին ատոմներից:

Իզոտոպները նույն թվով պրոտոններով, բայց նեյտրոնների տարբեր քանակով ատոմներ են: Քանի որ ատոմային թիվը հավասար է պրոտոնների թվին, իսկ ատոմային զանգվածը պրոտոնների և նեյտրոնների գումարն է, կարող ենք նաև ասել, որ իզոտոպները նույն ատոմային թվով, բայց տարբեր զանգվածային թվերով տարրեր են։
Ինչպե՞ս են տարրի իզոտոպները տարբերվում կիզլետից:

Նույն տարրի իզոտոպները տարբեր են, քանի որ նրանք ունեն տարբեր թվով նեյտրոններ և, հետևաբար, ունեն տարբեր ատոմային թվեր: Չնայած նեյտրոնների քանակի տարբերությանը, իզոտոպները քիմիապես նման են: Նրանք ունեն պրոտոնների և էլեկտրոնների նույնական թվեր, որոնք որոշում են քիմիական վարքագիծը
Ինչպե՞ս են տարբերվում ածխածնի իզոտոպները:

Ածխածին-12-ը և ածխածինը-14-ը ածխածնի տարրի երկու իզոտոպներ են: Ածխածին-12-ի և ածխածնի-14-ի միջև տարբերությունը նեյտրոնների քանակն է նրանց յուրաքանչյուր ատոմում: Ատոմի անունից հետո տրված թիվը ցույց է տալիս ատոմում կամ իոնում պրոտոնների գումարած նեյտրոնների թիվը։ Ածխածնի երկու իզոտոպների ատոմները պարունակում են 6 պրոտոն
Ինչպե՞ս են ատոմները և իզոտոպները նման:

Քիմիական տարրի ատոմները կարող են գոյություն ունենալ տարբեր տեսակների. Դրանք կոչվում են իզոտոպներ: Նրանք ունեն նույն թվով պրոտոններ (և էլեկտրոններ), բայց տարբեր թվով նեյտրոններ։ Նույն տարրի տարբեր իզոտոպներ ունեն տարբեր զանգվածներ
Ինչպե՞ս գիտենք, որ իզոտոպները գոյություն ունեն:

Իզոտոպները նույն տարրի ատոմներն են՝ տարբեր զանգվածներով։ Նրանք ստանում են այս տարբեր զանգվածները՝ ունենալով տարբեր թվով նեյտրոններ իրենց միջուկներում: Բնության մեջ հանդիպող ատոմների իզոտոպները լինում են երկու տեսակի՝ կայուն և անկայուն (ռադիոակտիվ)
