
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
Բացատրություն: Կողմնորոշման գործոն 0-ի և 1-ի միջև ընկած թիվ է: Այն ներկայացնում է an-ի բախումների բաժինը կողմնորոշում որը թույլ է տալիս տեղի ունենալ ռեակցիան: Ռեակցիան տեղի է ունենում, երբ երկակի կապը մոտենում է կապի դրական ջրածնային ծայրին:
Այսպիսով, կողմնորոշման գործոնը կախված է ջերմաստիճանից:
Անցումային վիճակի տեսություն Նախաէքսպոնենցիոնալ տեսություն Էմպիրիկ գործոն նույնպես զգայուն է ջերմաստիճանը . Ինչպես ջերմաստիճանը մեծանում է, մոլեկուլներն ավելի արագ են շարժվում; քանի որ մոլեկուլներն ավելի արագ են շարժվում, դրանք ավելի հավանական է բախվելու և հետևաբար ազդում բախման հաճախականության վրա, Ա.
Երկրորդ, ո՞րն է բախման մոդելը: Ըստ բախման մոդել , քիմիական ռեակցիա կարող է տեղի ունենալ միայն այն դեպքում, երբ ռեակտիվ մոլեկուլները, ատոմները կամ իոնները բախվել որոշակի քանակությամբ կինետիկ էներգիայով և ճիշտ կողմնորոշմամբ։ Այն բախման մոդել բացատրում է, թե ինչու, օրինակ, շատ բախումներ մոլեկուլների միջև չեն հանգեցնում քիմիական ռեակցիայի:
Ի՞նչ է նշանակում կողմնորոշում քիմիայում:
Կողմնորոշում մեջ քիմիա նշանակում է որ ընթացքում քիմիական արձագանքում է ատոմների միջև բախմանը: The reactant մոլեկուլները պետք է բախվեն բարենպաստ կողմնորոշում . Ճիշտը կողմնորոշում այն է, որն ապահովում է կապի խզման և ձևավորման մեջ ներգրավված ատոմի անմիջական շփումը:
Որո՞նք են բախումների տեսության պոստուլատները:
Բախման տեսություն հիմնված է երեքի վրա պոստուլատներ Քիմիական ռեակցիաները գազային փուլում պայմանավորված են բախում արձագանքող մասնիկներից: Ա բախում հանգեցնում է ռեակցիայի միայն այն դեպքում, երբ որոշակի սահմանային էներգիան գերազանցում է: Ա բախում հանգեցնում է ռեակցիայի միայն այն դեպքում, եթե բախվելով մասնիկները ճիշտ կողմնորոշված են միմյանց նկատմամբ:
Խորհուրդ ենք տալիս:
Ի՞նչ է նշանակում van't Hoff գործոնը:
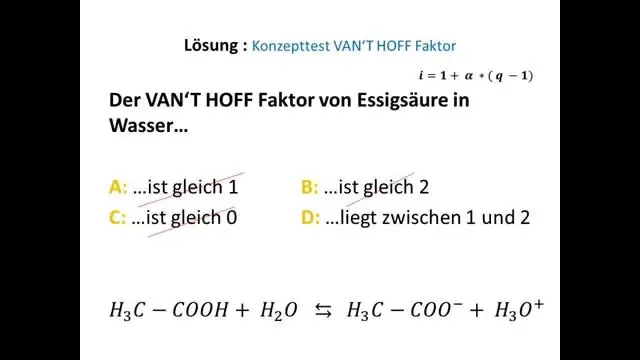
Wiki- Van't Hoff գործակիցը հարաբերակցությունն է մասնիկների փաստացի կոնցենտրացիայի, որն առաջանում է նյութի լուծարման ժամանակ և նյութի կոնցենտրացիայի միջև, որը հաշվարկվում է դրա զանգվածից: Ջրում լուծված ոչ էլեկտրոլիտների մեծամասնության համար van't Hoff գործակիցը հիմնականում 1 է
Ի՞նչ է ճառագայթման կշռման գործոնը:
Ճառագայթման կշռման գործակիցը տվյալ ճառագայթման մեկ միավորի չափաբաժնի արդյունավետության գնահատումն է ցածր-LET ստանդարտի նկատմամբ: Gy (ջոուլ/կգ) կարող է օգտագործվել ցանկացած տեսակի ճառագայթման համար: Gy-ը չի նկարագրում տարբեր ճառագայթների կենսաբանական ազդեցությունները
Ի՞նչ է իոնային փաթեթավորման գործոնը:

Իոնային փաթեթավորման գործոն (IPF), նմանատիպ սահմանում APF-ում: Նույն կանոնները, ինչ մետաղները՝ բյուրեղային համաչափության նկատմամբ: Իսկ եթե բյուրեղային կառուցվածքի իոնները. Կառուցվածք՝ CsCl տիպի Bravais վանդակ՝ պարզ խորանարդ Իոններ/միավոր բջիջ՝ 1 Cs + + 1 Cl ? Cl ? Cs + 7 (ոչ թե ատոմներ) 1
Ի՞նչ է զրոյական գործոնը:
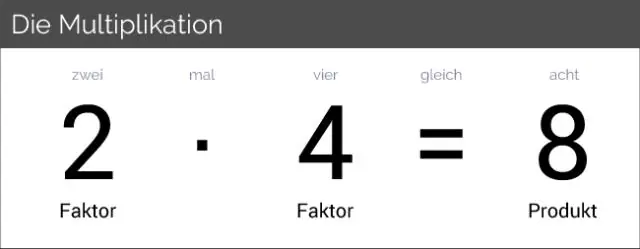
Զուր գործոնի օրենքը Եթե ցանկացած երկու թվի արտադրյալը զրո է, ապա թվերից մեկը կամ երկուսը զրո են: Այսինքն, եթե ab = 0, ապա a = 0 կամ b = 0 (որը ներառում է հնարավորություն, որ a = b = 0): Սա կոչվում է զրոյական գործոնի օրենք; և մենք հաճախ օգտագործում ենք այն քառակուսի հավասարումներ լուծելու համար
Ինչպե՞ս եք բաժանում գործոնը:

Հանրահաշվական բաժանում Բազմանանդամի ցուցիչները դասավորի՛ր նվազման կարգով: Շահաբաժնի առաջին անդամը (բաժանվող բազմանդամը) բաժանեք բաժանարարի առաջին անդամի վրա: Բաժանարարը բազմապատկեք քանորդի առաջին անդամով: Արտադրանքը հանեք շահաբաժինից և իջեցրեք հաջորդ անդամը
