
Բովանդակություն:
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:01.
Բուֆեր
- Եթե դուք ունեք միայն թույլ թթու . Որոշեք կոնցենտրացիան թթու (ենթադրելով, որ դիսոցացիա չկա): Փնտրեք կամ որոշեք Կա.
- Եթե դուք ունեք թույլ թթու ԵՎ խոնարհումը հիմք . Լուծել բուֆերի համար:
- Եթե դուք ունեք միայն կոնյուգատը հիմք . Լուծել -ի pH-ի համար հիմք օգտագործելով Կբ և հիդրոլիզի հավասարումը։
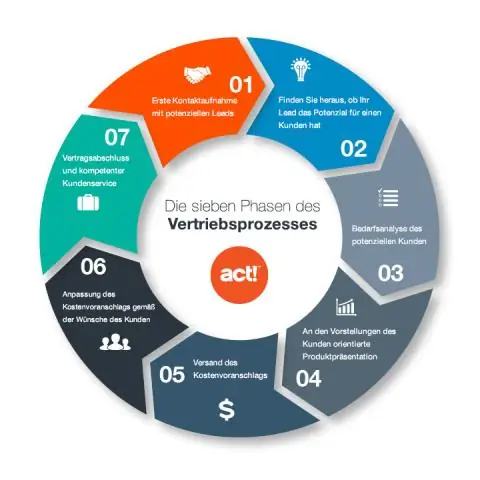
Ըստ այդմ՝ ինչպե՞ս եք անում թթվային հիմքի տիտրումը:
Տիտրման կարգը
- Բյուրետը ողողեք ստանդարտ լուծույթով, պիպետտն անհայտ լուծույթով, իսկ կոնաձև կոլբը թորած ջրով:
- Տեղադրեք անալիտի ճշգրիտ չափված ծավալը Էրլենմայերի կոլբայի մեջ՝ օգտագործելով pipette՝ ցուցիչի մի քանի կաթիլների հետ միասին:
Նմանապես, ինչպե՞ս եք հաշվարկում տիտրումը: Օգտագործեք տիտրման բանաձև . Եթե տիտրը և անալիտը ունեն 1:1 մոլային հարաբերակցություն, ապա բանաձեւ է մոլարիականություն (M) թթվի x թթվի ծավալը (V) = մոլարիականություն (M) հիմքի x հիմքի ծավալը (V): ( Մոլարություն է կենտրոնացում լուծույթի, որն արտահայտվում է որպես լուծույթի մոլերի քանակ մեկ լիտր լուծույթի վրա։)
Բացի այդ, F-ն ուժեղ կամ թույլ հիմք է:
Հետեւաբար, Ի- ամենակայունն է և ամենաքիչ հիմնականը, մինչդեռ Ֆ - ամենաքիչ կայուն է և ամենահիմնականը: Ուժեղ հիմքեր հետ ամբողջությամբ շփվել ուժեղ թթուներ, ինչպիսիք են HCl-ը, չեզոքացման ռեակցիայի ժամանակ աղ և ջուր ձևավորելու համար: Այլ ամուր հիմքեր լուծելի օքսիդներ են, ինչպես Na2O և լուծվող հիդրօքսիդի աղեր: Ուժեղ հիմքեր են ուժեղ էլեկտրոլիտներ.
Ինչի համար է օգտագործվում տիտրումը:
Ա տիտրում տեխնիկա է, որտեղ հայտնի կոնցենտրացիայի լուծույթ է սովոր է որոշել անհայտ լուծույթի կոնցենտրացիան. Սովորաբար, տիտրանտը (գիտելիքի լուծույթը) բյուրետից ավելացվում է անալիտի հայտնի քանակին (անհայտ լուծույթ), մինչև ռեակցիան ավարտվի:
Խորհուրդ ենք տալիս:
Որո՞նք են սպիտակուցի սինթեզի 9 քայլերը:

Սպիտակուցի սինթեզ՝ քայլ 1 - ազդանշան. ինչ-որ ազդանշան է տեղի ունենում, որը պահանջում է հատուկ սպիտակուցի արտադրություն: սպիտակուցի սինթեզ. քայլ 2 - ացետիլացում: ինչու ԴՆԹ գեները միշտ հեշտ հասանելի չեն: սպիտակուցի սինթեզ՝ քայլ 3 - տարանջատում. ԴՆԹ-ի հիմքերը. ԴՆԹ-ի հիմքերի զույգեր. սպիտակուցի սինթեզ. քայլ 4 - տառադարձում: արտագրում
Որո՞նք են այն քայլերը, որոնք ընդգրկված են էլեկտրապատման մեջ:

Հետևյալը նկարագրում է այն քայլերը, որոնք ձեռնարկվել են տիպիկ ցինկի էլեկտրալվացման գործընթացում: Քայլ 1 – Մաքրում ենթաշերտը: Քայլ 2 – Ենթաշերտի ակտիվացում: Քայլ 3 – Ծաղկապատման լուծույթի պատրաստում: Քայլ 4 – Ցինկի Էլեկտրապատում: Քայլ 5 – ողողում և չորացում
Որո՞նք են ազդանշանի փոխանցման ուղու քայլերը:
Բջջային ազդանշանի երեք փուլ Բջջային ազդանշանը կարելի է բաժանել 3 փուլի: Ընդունում. Բջիջը հայտնաբերում է ազդանշանային մոլեկուլը բջջի արտաքինից: Փոխակերպում. Երբ ազդանշանային մոլեկուլը կապում է ընկալիչին, այն ինչ-որ կերպ փոխում է ընկալիչի սպիտակուցը: Արձագանք. Ի վերջո, ազդանշանն առաջացնում է հատուկ բջջային արձագանք
Որո՞նք են բառային խնդիրների լուծման քայլերը:
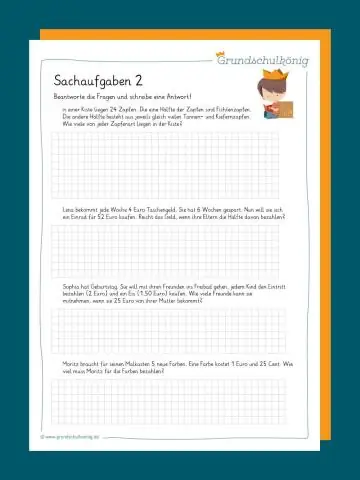
Բառային խնդիրների լուծման պարզ քայլեր Կարդացեք խնդիրը: Սկսեք ուշադիր կարդալով խնդիրը: Բացահայտեք և թվարկեք փաստերը: Պարզեք, թե կոնկրետ ինչ է պահանջում խնդիրը: Վերացրեք ավելորդ տեղեկատվությունը. Ուշադրություն դարձրեք չափման միավորներին. Գծեք դիագրամ: Գտեք կամ մշակեք բանաձև: Խորհրդակցեք հղումով
Որո՞նք են հավասարումների լուծման քայլերը:

Երկաստիճան հանրահաշվական հավասարումը լուծելու համար ընդամենը պետք է մեկուսացնել փոփոխականը՝ օգտագործելով գումարում, հանում, բազմապատկում կամ բաժանում: Լուծե՛ք երկքայլ հավասարումը՝ վերջում բազմապատկելով՝ բաժանելու փոխարեն: x/5 + 7 = -3 = (x/5 + 7) - 7 = -3 - 7 = x/5 = -10: x/5 * 5 = -10 * 5. x = -50
