
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
Ո՞ր էլեկտրոնային կոնֆիգուրացիան է ներկայացնում քլորի ատոմը գրգռված վիճակում: (2) 2-8-6-1 սա քլորի գրգռված վիճակն է, պարբերական աղյուսակում հիմնական վիճակը 2-8-7 է: Գրգռված վիճակի էլեկտրոնի կոնֆիգուրացիան ցույց է տալիս, որ էլեկտրոնը թողնում է մեկը էներգիա մակարդակ և բարձրանալ ավելի բարձր մակարդակ:
Պարզապես, ի՞նչ է նշանակում, երբ ատոմը գրգռված վիճակում է:
Ան հուզված - պետական ատոմ է ատոմ որոնցում էլեկտրոնների ընդհանուր էներգիան կարող է իջեցվել՝ մեկ կամ մի քանի էլեկտրոններ տարբեր ուղեծրեր տեղափոխելու միջոցով։ Այսինքն՝ ան հուզված - պետական ատոմ ոչ բոլոր էլեկտրոններն են գտնվում էներգիայի հնարավոր ամենացածր մակարդակներում:
Նմանապես, քանի՞ էլեկտրոն կա քլորի անիոնում Cl-ում: Ձախ կողմում` քլորին ատոմն ունի 17 էլեկտրոններ . Աջ կողմում, քլորիդ իոն ունի 18 էլեկտրոններ և ունի 1 − գանձել։
Բացի այդ, ինչպիսի՞ն է կալիումի հուզված վիճակը։
Քանի որ կա միայն մեկ հնարավոր հիմք պետություն էլեկտրոնի կոնֆիգուրացիա չեզոք տարրի համար, ցանկացած այլ դասավորվածություն կալիում 19 էլեկտրոնն ավելի մեծ էներգիա ունի և ան հուզված վիճակ.
Ի՞նչ է տեղի ունենում, երբ էլեկտրոնները գրգռված են:
Երբ ան էլեկտրոն կլանում է էներգիան, այն ցատկում է դեպի ավելի բարձր ուղեծիր: Ան էլեկտրոն մի հուզված վիճակը կարող է էներգիա ազատել և «ընկնել» ավելի ցածր վիճակի: Երբ դա տեղի ունենա, ապա էլեկտրոն արձակում է էլեկտրամագնիսական էներգիայի ֆոտոն։ Այն էլեկտրոն կարող է կլանել մեկ քվանտ էներգիա և ցատկել մինչև գրգռման վիճակ:
Խորհուրդ ենք տալիս:
Ո՞րն է SPD և F բլոկի տարրերի ընդհանուր էլեկտրոնային կոնֆիգուրացիան:

Գրեք s-, p-, d- և f- բլոկի տարրերի ընդհանուր արտաքին էլեկտրոնային կոնֆիգուրացիան: Տարր Ընդհանուր արտաքին էլեկտրոնային կոնֆիգուրացիա p–բլոկ (մետաղներ և ոչ մետաղներ) ns2np1–6, որտեղ n = 2 – 6 d–բլոկ (անցումային տարրեր) (n–1) d1–10 ns0–2, որտեղ n = 4 – 7 f –բլոկ(ներքին անցումային տարրեր) (n–2)f1–14(n–1)d0–10ns2, որտեղ n = 6 – 7
Ինչպե՞ս է էլեկտրոնային կոնֆիգուրացիան կապված քվանտային թվերի հետ:
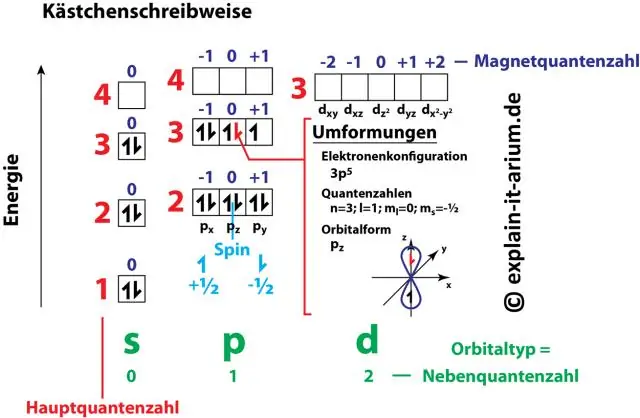
Էլեկտրոնային կոնֆիգուրացիայի մեջ թվերի և տառերի զույգերը ներկայացնում են էլեկտրոնի չորս քվանտային թվերից երկուսը: Այս քվանտային թվերը մեզ ավելի շատ տեղեկություններ են տալիս էլեկտրոնների և նրանց ուղեծրերի հատկությունների մասին: Հիմնական քվանտային թիվը (n) ցույց է տալիս էլեկտրոնի էներգիայի մակարդակը և չափը
Ո՞ր տարրն ունի էլեկտրոնային կոնֆիգուրացիան 2 5:

ՆԿԱՐ 5.9 Սլաքը ցույց է տալիս ենթամակարդակների լրացման հերթականությունը հիշելու երկրորդ եղանակը: Աղյուսակ 5.2-ում ներկայացված են 1-ից 18 ատոմային թվերով տարրերի էլեկտրոնային կոնֆիգուրացիաները: Տարր Ատոմային թիվ Էլեկտրոնի կոնֆիգուրացիա ծծումբ 16 1s22s22p63s23p4 քլոր 17 1s22s22p63s23p5 արգոն 18 1s632s
Ինչպե՞ս եք գրում MN-ի էլեկտրոնային կոնֆիգուրացիան:

Մյուս կողմից, մանգանն ունի 1s22s22p63s23p64s23d5 էլեկտրոնային կոնֆիգուրացիա և [Ar]4s23d5 ազնիվ գազի կոնֆիգուրացիա, ինչը հանգեցնում է մեկ չզույգված էլեկտրոնի յուրաքանչյուր 3d ենթաօրբիտալում։
Ո՞ր էլեկտրոնային կոնֆիգուրացիան է ներկայացնում ատոմը իր հիմնական վիճակում:

Այսպիսով, ցանկացած էլեկտրոնային կոնֆիգուրացիա, որտեղ վերջին էլեկտրոնը (կրկին վալենտային էլեկտրոնը) գտնվում է ավելի բարձր էներգիայի ուղեծրում, այս տարրն ասում են, որ գրգռված վիճակում է: Օրինակ, եթե նայենք թթվածնի հիմնական վիճակին (էլեկտրոնները էներգետիկորեն ամենացածր հասանելի ուղեծրում), ապա էլեկտրոնների կոնֆիգուրացիան 1s22s22p4 է։
