
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
Իդեալական գազի օրենքը, ինչպես ասում են, իրականում կա PV = nRT , բոլոր ստանդարտ փոփոխականներով: Այստեղ n=m/M, որտեղ m-ը գազի զանգվածն է, իսկ M-ը՝ գազի մոլեկուլային զանգվածը: Մի խոսքով, R in PV = nRT կրճատվում է գործակցով M-ով (մոլեկուլային քաշ) R-ն մուտքագրելու համար PV = mRT.
Պարզապես, ինչի՞ է հավասար r-ն pV nRT-ում:
Գազի իդեալական օրենքը հետևյալն է. pV = nRT , որտեղ n-ը խալերի թիվն է, և Ռ ունիվերսալ գազի հաստատուն է։ -ի արժեքը Ռ կախված է ներգրավված ստորաբաժանումներից, բայց սովորաբար նշվում է S. I. միավորների հետ որպես. Ռ = 8.314 Ջ/մոլ. Սա նշանակում է, որ օդի համար կարող եք օգտագործել արժեքը Ռ = 287 Ջ/կգ:
Նմանապես, ի՞նչ է նշանակում R-ն քիմիայում pV nRT: Համընդհանուր գազի հաստատունի միավորները Ռ բխում է PV=n հավասարումից Ռ Տ. Այն կանգնած է Regnault-ի համար:
Այս առումով, ինչ է նշանակում N-ը pV nRT-ում:
. Ֆիզիկական օրենք, որը նկարագրում է իդեալական գազի չափելի հատկությունների փոխհարաբերությունները, որտեղ P (ճնշում) × V (ծավալ) = (մոլերի թիվը) × R (գազի հաստատուն) × T (ջերմաստիճանը Քելվինում): Այն առաջացել է Բոյլի, Չարլզի և Ավոգադրոյի գազային օրենքների համակցումից։ Նաև կոչվում է գազի համընդհանուր օրենք:
Ի՞նչ է M-ն իդեալական գազի օրենքում:
Բնօրինակը իդեալական գազի օրենք օգտագործում է PV =nRT բանաձևը, որի խտության տարբերակը իդեալական գազի օրենք PM = dRT է, որտեղ P-ն ճնշում է, որը չափվում է մթնոլորտում (atm), T-ն ջերմաստիճանը չափվում է կելվինով (K), R-ն է՝ իդեալական գազի օրենք հաստատուն0,0821 ժամը մ (L) մ ol(K) ճիշտ այնպես, ինչպես սկզբնական բանաձևում, բայց Մ այժմ մոլային զանգվածն է (g մ ոլ
Խորհուրդ ենք տալիս:
Ո՞րն է տարբերությունը օսմոսի դիֆուզիայի և հեշտացված դիֆուզիայի միջև:

Օսմոզ է առաջանում նաև, երբ ջուրը մի բջիջից մյուսը տեղափոխվում է: Մյուս կողմից, հեշտացված դիֆուզիան տեղի է ունենում, երբ բջիջը շրջապատող միջավայրը գտնվում է իոնների կամ մոլեկուլների բարձր կոնցենտրացիայի մեջ, քան բջջի միջավայրում: Մոլեկուլները շարժվում են շրջակա միջավայրից դեպի բջիջ՝ դիֆուզիոն գրադիենտի պատճառով
Ո՞րն է տարբերությունը հարաբերակցության և խի քառակուսու միջև:

Այսպիսով, հարաբերակցությունը վերաբերում է երկու փոփոխականների միջև գծային հարաբերություններին: Սովորաբար, երկուսն էլ շարունակական են (կամ գրեթե այդպես), բայց կան տատանումներ այն դեպքերի համար, երբ մեկը երկակի է: Chi-square-ը սովորաբար երկու փոփոխականների անկախության մասին է: Սովորաբար երկուսն էլ կատեգորիկ են
Ո՞րն է տարբերությունը կլիմայական գոտու և բիոմի միջև:

Կլիման դասակարգվում է՝ ելնելով մթնոլորտային ջերմաստիճանից և տեղումներից, մինչդեռ բիոմը դասակարգվում է հիմնականում՝ հիմնվելով բուսականության միատեսակ տեսակների վրա: Կլիման կարող է որոշել, թե ինչ բիոմ կա, բայց բիոմը սովորաբար չի վերահսկում կամ ազդում կլիմայի վրա նույն կերպ
Ո՞րն է տարբերությունը կոշտ և փափուկ լուսավորության միջև:

Փափուկ լույսի և կոշտ լույսի տարբերությունը. Կոշտ լույսը ստեղծում է հստակ, կոշտ եզրերով ստվերներ: Փափուկ լույսը ստեղծում է ստվերներ, որոնք հազիվ տեսանելի են: Արևոտ օրը ծանր լույս է
Ո՞րն է տարբերությունը ընդհանուր քիմիայի և օրգանական քիմիայի միջև:
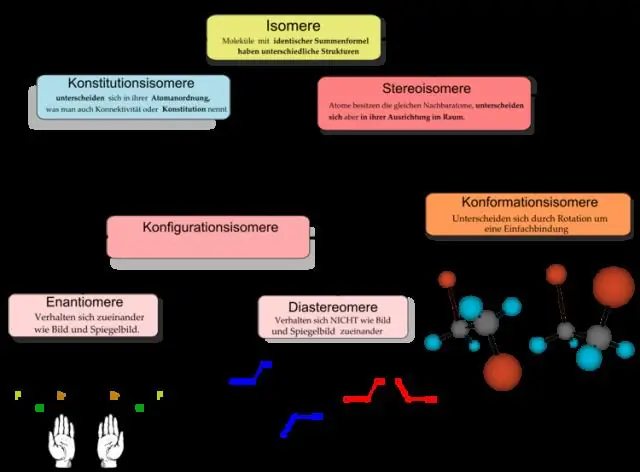
Օրգանական քիմիան համարվում է քիմիայի ենթաճյուղ։ Մինչդեռ «քիմիա» ընդհանուր տերմինը վերաբերում է ընդհանրապես բոլոր նյութերի բաղադրությանը և փոխակերպմանը, օրգանական քիմիան սահմանափակվում է միայն օրգանական միացությունների ուսումնասիրությամբ։
