
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:01.
ՏԵՍԱՆՅՈՒԹ
Հետո ինչպե՞ս եք լուծում ատոմային զանգվածի խնդիրները:
Դեպի հաշվարկել որ ատոմային զանգված տարրի մեկ ատոմից, գումարեք զանգվածային պրոտոնների և նեյտրոնների. Օրինակ՝ Գտեք ատոմային զանգված ածխածնի իզոտոպ, որն ունի 7 նեյտրոն։ Պարբերական աղյուսակից կարելի է տեսնել, որ ածխածինը ունի ան ատոմային 6 թիվը, որը նրա պրոտոնների թիվն է։
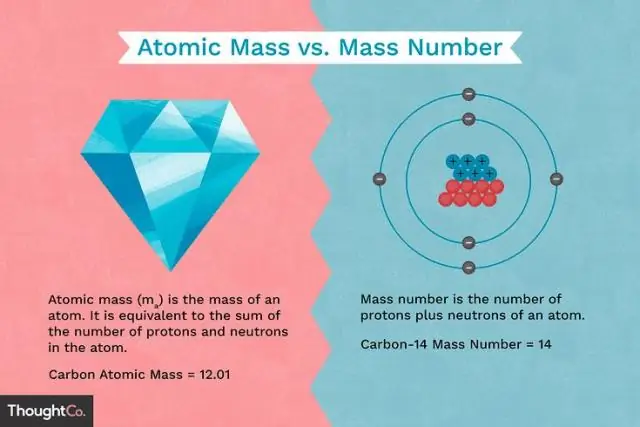
Բացի այդ, ո՞րն է ատոմային զանգվածային թիվը: Այն զանգվածային համարը (խորհրդանիշ Ա, գերմաներեն Atomgewicht բառից [ ատոմային քաշը]), որը նաև կոչվում է ատոմային զանգվածային թիվը կամ նուկլեոն թիվ , ընդհանուրն է թիվ պրոտոնների և նեյտրոնների (միասին հայտնի են որպես նուկլեոններ) մի ատոմային միջուկ. Այն զանգվածային համարը տարբեր է քիմիական տարրի յուրաքանչյուր տարբեր իզոտոպի համար:
Նաև պետք է իմանալ, թե որն է ատոմային զանգվածի բանաձևը:
Միջին ատոմային զանգված = զ1Մ1 + զ2Մ2 +… + զ Մ որտեղ f-ը իզոտոպի բնական առատությունը ներկայացնող մասն է, իսկ M-ը զանգվածային իզոտոպի թիվը (քաշը). Միջին ատոմային զանգված տարրը կարելի է գտնել պարբերական աղյուսակում, սովորաբար տարրական նշանի տակ:
Որքա՞ն է միջին ատոմային զանգվածը քիմիայում:
Այն միջին ատոմային զանգված տարրի գումարն է զանգվածները իր իզոտոպներից յուրաքանչյուրը բազմապատկված իր բնական առատությամբ (տասնորդականը՝ կապված տոկոսի հետ ատոմներ այդ տարրի, որոնք տրված իզոտոպից են):
Խորհուրդ ենք տալիս:
Ո՞րն է տարբերությունը պրոտոնի զանգվածի և էլեկտրոնի զանգվածի միջև:
Պրոտոններն ու նեյտրոններն ունեն մոտավորապես նույն զանգվածը, բայց երկուսն էլ շատ ավելի զանգված են, քան էլեկտրոնները (մոտ 2000 անգամ ավելի զանգված, քան էլեկտրոնը)։ Պրոտոնի դրական լիցքը մեծությամբ հավասար է էլեկտրոնի բացասական լիցքին
Ինչպե՞ս եք լուծում սահմանափակող ռեակտիվ զանգվածի խնդիրները:

Գտեք սահմանափակող ռեագենտը՝ հաշվարկելով և համեմատելով յուրաքանչյուր ռեակտիվ արտադրվող արտադրանքի քանակը: Հավասարակշռել քիմիական ռեակցիայի քիմիական հավասարումը: Տրված տեղեկատվությունը վերածիր խալերի։ Օգտագործեք ստոիքիոմետրիա յուրաքանչյուր առանձին ռեակտիվ նյութի համար՝ արտադրված արտադրանքի զանգվածը գտնելու համար
Ինչպե՞ս եք հաշվարկում տիտրման խնդիրները:

Տիտրման խնդիր Քայլ առ քայլ լուծում Քայլ 1. Որոշեք [OH-] NaOH-ի յուրաքանչյուր մոլ կունենա մեկ մոլ OH-: Քայլ 2. Որոշեք OH-ի մոլերի քանակը: Քայլ 3. Որոշեք H+ մոլերի քանակը Քայլ 4. Որոշեք HCl-ի կոնցենտրացիան
Ինչու՞ է բարձր զանգվածի աստղը տարբեր կերպ զարգանում ցածր զանգվածի աստղից:

Ինչու՞ է բարձր զանգվածի աստղը զարգանում տարբեր կերպ, քան ցածր զանգվածի աստղը: Ա) Այն կարող է ավելի շատ վառելիք այրել, քանի որ նրա միջուկը կարող է ավելի տաքանալ: Այն ունի ավելի ցածր ձգողականություն, ուստի այն չի կարող ավելի շատ վառելիք քաշել տիեզերքից
Ինչպե՞ս է չափվում ատոմային զանգվածի միավորը:

Ատոմային զանգվածի միավոր: Ատոմային զանգվածի միավորը (կրճատ՝ amu, u կամ Da) չափման միավոր է, որն օգտագործվում է ատոմների զանգվածը չափելու համար։ Ատոմային զանգվածի միավորը հավասար է ածխածնի 12 զանգվածի 1⁄12-ին։ «Դալթոն» բառը ժամանակի ընթացքում ավելի է օգտագործվում
