
- Հեղինակ Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:01.
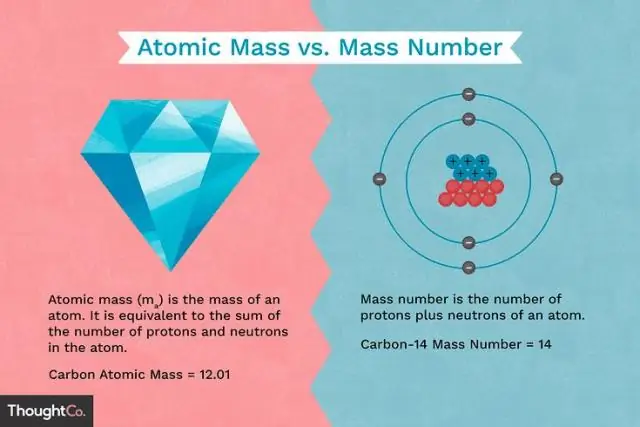
Ատոմային զանգվածի միավոր . Ան ատոմային զանգվածի միավոր (կրճատ՝ ամու, ու կամ Դա) ա միավոր -ից չափում որ սովոր է չափել որ զանգվածային -ից ատոմներ . Այն ատոմային զանգվածի միավոր հավասար է1⁄12 որ զանգվածային ածխածնի-12. «Դալթոն» բառը ժամանակի ընթացքում ավելի է օգտագործվում:
Այս կերպ ինչպե՞ս է չափվում ատոմային զանգվածը։
Այն ատոմային զանգված տարրի միջինը զանգվածային որ ատոմներ տարրից չափված մեջ ատոմային զանգված միավոր (ամու, հայտնի է նաև որպես դալթոններ, D): Այն ատոմային զանգված միջին կշռված է այդ տարրի բոլոր իզոտոպների, որոնցում զանգվածային յուրաքանչյուր իզոտոպը բազմապատկվում է տվյալ իզոտոպի առատությամբ:
Ավելին, ատոմային զանգվածն ունի՞ միավորներ: Մինչդեռ ատոմային զանգված բացարձակ է զանգվածային , հարաբերական իզոտոպ զանգվածային անչափ թիվ է, որի ոչ միավորներ . Օրինակ՝ հարաբերական իզոտոպը զանգվածային ածխածնի-12 ատոմ ճիշտ 12 է: Համեմատության համար նշենք ատոմային զանգված ածխածնի-12 ատոմ ուղիղ 12 դալտոն է։
Հաշվի առնելով սա, ո՞ր քանակությունն է չափվում ատոմային զանգվածի միավորով:
Ատոմային զանգված . Ատոմային զանգված , է քանակ նյութի մեջ պարունակվող ան ատոմ տարրից։ Այն արտահայտվում է որպես տասներկուերորդականի բազմապատիկ զանգվածային ածխածնի-12 ատոմ , 1.992646547 × 10−23 գրամ, որը նշանակվում է ան ատոմային զանգված 12-ից միավորներ . Այս մասշտաբով 1 ատոմային զանգվածի միավոր (amu) համապատասխանում է 1,660539040 × 10−24 գրամ
Ո՞րն է ատոմային զանգվածի միավորը քիմիայում:
Մեջ քիմիա , ան ատոմային զանգվածի միավոր կամ AMU-ն ֆիզիկական հաստատուն է, որը հավասար է տասներկուերորդին զանգվածային անկաշկանդ ատոմ ածխածնի-12. Դա է միավոր -ից զանգվածային օգտագործվում է արտահայտելու համար ատոմային զանգվածներ և մոլեկուլային զանգվածները.
Խորհուրդ ենք տալիս:
Ո՞րն է տարբերությունը պրոտոնի զանգվածի և էլեկտրոնի զանգվածի միջև:
Պրոտոններն ու նեյտրոններն ունեն մոտավորապես նույն զանգվածը, բայց երկուսն էլ շատ ավելի զանգված են, քան էլեկտրոնները (մոտ 2000 անգամ ավելի զանգված, քան էլեկտրոնը)։ Պրոտոնի դրական լիցքը մեծությամբ հավասար է էլեկտրոնի բացասական լիցքին
Ինչպե՞ս եք հաշվարկում ատոմային զանգվածի պրակտիկայի խնդիրները:

ՏԵՍԱՆՅՈՒԹ Հետո ինչպե՞ս եք լուծում ատոմային զանգվածի խնդիրները: Դեպի հաշվարկել որ ատոմային զանգված տարրի մեկ ատոմից, գումարեք զանգվածային պրոտոնների և նեյտրոնների. Օրինակ՝ Գտեք ատոմային զանգված ածխածնի իզոտոպ, որն ունի 7 նեյտրոն։ Պարբերական աղյուսակից կարելի է տեսնել, որ ածխածինը ունի ան ատոմային 6 թիվը, որը նրա պրոտոնների թիվն է։ Բացի այդ, ո՞րն է ատոմային զանգվածային թիվը:
Ո՞րն է մոլային զանգվածի միավորը:

Հայեցակարգը, որը թույլ է տալիս մեզ կամրջել այս երկու մասշտաբները, մոլային զանգվածն է: Մոլային զանգվածը սահմանվում է որպես նյութի մեկ մոլի զանգվածը գրամներով: Մոլային զանգվածի միավորներն են գրամ մոլի վրա, կրճատ՝ գ/մոլ
Ինչու՞ է բարձր զանգվածի աստղը տարբեր կերպ զարգանում ցածր զանգվածի աստղից:

Ինչու՞ է բարձր զանգվածի աստղը զարգանում տարբեր կերպ, քան ցածր զանգվածի աստղը: Ա) Այն կարող է ավելի շատ վառելիք այրել, քանի որ նրա միջուկը կարող է ավելի տաքանալ: Այն ունի ավելի ցածր ձգողականություն, ուստի այն չի կարող ավելի շատ վառելիք քաշել տիեզերքից
Ինչու՞ է պարբերական աղյուսակը դասավորված ատոմային թվով և ոչ ատոմային զանգվածով:

Ինչու՞ է Պարբերական աղյուսակը դասավորված ատոմային թվով և ոչ ատոմային զանգվածով: Ատոմային թիվը յուրաքանչյուր տարրի ատոմների միջուկում պրոտոնների թիվն է։ Այդ թիվը եզակի է յուրաքանչյուր տարրի համար: Ատոմային զանգվածը որոշվում է միավորված պրոտոնների և նեյտրոնների քանակով
