
- Հեղինակ Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:01.
| Ջերմաստիճանը (K) | Գէջ (Ջ/մոլ*Կ) | H° - H°298.15 (կՋ/մոլ) |
|---|---|---|
| 298. | 59.52 | -0.00 |
| 300. | 59.67 | 0.12 |
| 400. | 64.94 | 6.34 |
| 500. | 75.16 | 13.29 |
Ըստ այդմ, որքա՞ն է HCl-ի և NaOH-ի տեսակարար ջերմունակությունը:
Հատուկ ջերմություն -ից HCl & NaOH Լուծում=4,017 Ջ/գ°C։
Նաև, ո՞րն է nacl-ի էթալպիան: Այսպիսով, երբ 1 մոլ նատրիումի քլորիդ բյուրեղները լուծվում են ջրի ավելցուկում, էթալպիա լուծույթի փոփոխությունը +3,9 կՋ մոլ է-1. Փոփոխությունը փոքր-ինչ էնդոթերմիկ է, ուստի լուծույթի ջերմաստիճանը մի փոքր ցածր կլինի սկզբնական ջրի ջերմաստիճանից:
Նմանապես, ո՞րն է նատրիումի հիդրօքսիդի օգտագործումը:
- Այն ջրահեռացման և ջեռոցների մաքրման հիմնական բաղադրիչն է:
- Այն օգտագործվում է քիմիական արտադրության, նավթի վերամշակման, հիդրավլիկ ճեղքման, ջրի մաքրման և մետաղների մշակման մեջ:
- Այն օգտագործվում է գործվածքի, պոլիէթիլենային թաղանթի, թղթի և օճառի արտադրության մեջ։
Ինչպե՞ս եք հաշվարկում հատուկ ջերմային հզորությունը:
-ի միավորները հատուկ ջերմային հզորություն են J/(kg °C) կամ համարժեք J/(kg K): Այն ջերմային հզորություն եւ հատուկ ջերմություն կապված են C=cm կամ c=C/m-ով: Զանգվածը մ, հատուկ ջերմություն գ, ջերմաստիճանի փոփոխություն ΔT, և ջերմություն ավելացված (կամ հանված) Q-ն առնչվում են հավասարումը Q=mcΔT.
Խորհուրդ ենք տալիս:
Ինչպե՞ս է կոչվում աղաթթվի և նատրիումի հիդրօքսիդի չեզոքացման արդյունքում առաջացած աղը:
Բացատրություն. Նատրիումի հիդրօքսիդի (NaOH) և աղաթթվի (HCl) ռեակցիան չեզոքացման ռեակցիա է, որը հանգեցնում է աղի, նատրիումի քլորիդի (NaCl) և ջրի (H2O) ձևավորմանը: Դա էկզոտերմիկ ռեակցիա է
Որքա՞ն է օկտանի հատուկ ջերմային հզորությունը:

Օկտանային անվանումներ Ջերմային հզորություն (C) 255,68 J K&մինուս;1 մոլ&մինուս;1 Std մոլային էնտրոպիա (So298) 361,20 J K&մինուս;1 մոլ&մինուս;1 Std առաջացման էնթալպիա (ΔfH?298) &մինուս 252,1 մինուս; մոլար&8minus; 1 Std այրման էնթալպիա (ΔcH?298) &մինուս;5.53–&մինուս;5.33 ՄՋ մոլ&մինուս;1
Ինչպե՞ս ենք հաշվարկում հատուկ ջերմային հզորությունը:
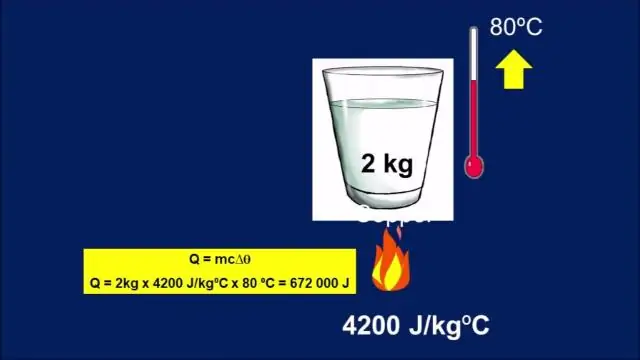
Հատուկ ջերմային հզորության միավորներն են J/(kg °C) կամ համարժեք J/(kg K): Ջերմունակությունը և տեսակարար ջերմությունը կապված են C=cm կամ c=C/m-ով: m զանգվածը, հատուկ ջերմությունը c, ջերմաստիճանի փոփոխությունը ΔT և ավելացված (կամ հանված) Q ջերմությունը կապված են Q=mcΔT հավասարման միջոցով:
Ո՞րն է կերամիկայի հատուկ ջերմային հզորությունը:

Կերամիկական նյութերը, ինչպիսիք են բետոնը կամ աղյուսը, ունեն հատուկ ջերմային հզորություն մոտ 850 J կգ-1 K-1
Ի՞նչ է ջերմային հզորությունը ընդդեմ հատուկ ջերմության:

Մոլային ջերմային հզորությունը ջերմության քանակի չափումն է, որն անհրաժեշտ է մաքուր նյութի մեկ մոլի ջերմաստիճանը մեկ Կ աստիճանով բարձրացնելու համար: Հատուկ ջերմային հզորությունը չափում է ջերմության քանակությունը, որն անհրաժեշտ է մաքուր նյութի մեկ գրամ ջերմաստիճանը բարձրացնելու համար: նյութը մեկ աստիճանով Կ
