Բովանդակություն:
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
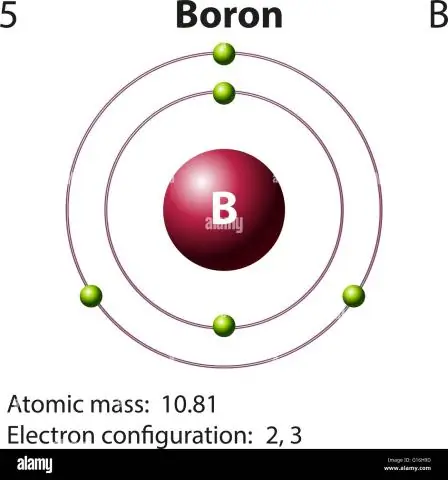
Բորի համար այս հավասարումը կունենա հետևյալ տեսքը
- 5 պրոտոն + 5 նեյտրոն = 10 ատոմային զանգված միավորներ (AMU) կամ ավելի հաճախ հանդիպողների համար բոր իզոտոպ (մոտ.
- 5 պրոտոն + 6 նեյտրոն = 11 ԱՄՈՒ:
Հաշվի առնելով սա՝ ո՞րն է բորի ատոմային զանգվածը:
10.811 u
Նաև ինչպե՞ս եք հաշվարկում նեոնի ատոմային զանգվածը: 20.1797 u
Մարդիկ նաև հարցնում են՝ ինչպե՞ս եք հաշվում ատոմային զանգվածը։
Դեպի հաշվարկել ատոմային զանգվածը մի սինգլից ատոմ մի տարրի, գումարել զանգվածային պրոտոնների և նեյտրոնների. Օրինակ՝ Գտեք ատոմային զանգված ածխածնի իզոտոպ, որն ունի 7 նեյտրոն։ Պարբերական աղյուսակից կարելի է տեսնել, որ ածխածինը ունի ան ատոմային 6 թիվը, որը նրա պրոտոնների թիվն է։
Որքա՞ն է 1 ամու զանգվածը:
Ատոմային զանգվածի միավորը (խորհրդանշվում է AMU կամ amu) սահմանվում է որպես ածխածնի 12 ատոմի զանգվածի ճշգրիտ 1/12: Ածխածնի-12 (C-12) ատոմն ունի վեց պրոտոններ և վեց նեյտրոններ իր միջուկում։ Անճշգրիտ առումով, մեկ AMU-ն միջինն է պրոտոն հանգստի զանգվածը և նեյտրոն հանգստի զանգված.
Խորհուրդ ենք տալիս:
Ի՞նչ է Նիլ Բորի ատոմային մոդելը:

Նիլս Բորն առաջարկել է ատոմի Բորի մոդելը 1915 թվականին: Բորի մոդելը մոլորակային մոդել է, որտեղ բացասական լիցքավորված էլեկտրոնները պտտվում են փոքր, դրական լիցքավորված միջուկի շուրջ, որը նման է արևի շուրջ պտտվող մոլորակներին (բացառությամբ, որ ուղեծրերը հարթ չեն):
Ինչպե՞ս եք հաշվարկում ստրոնցիումի միջին ատոմային զանգվածը:
Այսպիսով, մենք հաշվարկում ենք այն՝ վերցնելով իզոտոպներից յուրաքանչյուրի կշռված զանգվածը և գումարելով դրանք։ Այսպիսով, առաջին զանգվածի համար մենք կբազմապատկենք 84-ի 0,50%-ը (ամու - ատոմային զանգվածի միավորներ) = 0,042 ամու, և այն կավելացնենք 86 ամու = 8,51 ամու 9,9%-ին և այլն:
Ինչպե՞ս է որոշվում պարբերական աղյուսակում ներկայացված միջին ատոմային զանգվածը:
Տարրի միջին ատոմային զանգվածը հաշվարկվում է՝ գումարելով տարրի իզոտոպների զանգվածները, որոնցից յուրաքանչյուրը բազմապատկվում է Երկրի վրա իր բնական առատությամբ: Տարրերի կամ միացությունների հետ կապված զանգվածի հաշվարկներ կատարելիս միշտ օգտագործեք միջին ատոմային զանգվածը, որը կարելի է գտնել պարբերական աղյուսակում։
Ո՞րն է կայուն ուղեծիրը Բորի ատոմային մոդելում:

Ատոմն ունի մի շարք կայուն ուղեծրեր, որոնցում էլեկտրոնը կարող է բնակվել առանց ճառագայթային էներգիայի արտանետման։ Յուրաքանչյուր ուղեծիր համապատասխանում է էներգիայի որոշակի մակարդակի: 4. Միջուկի շուրջ հատուկ մակերեսը, որը պարունակում էր հավասար էներգիայի և շառավղով ուղեծրեր, կոչվում էր թաղանթ:
Ինչպե՞ս է Բորի մոդելը բացատրում ատոմային սպեկտրները:

Նիլս Բորը բացատրեց ջրածնի ատոմի գծային սպեկտրը՝ ենթադրելով, որ էլեկտրոնը շարժվում է շրջանաձև ուղեծրերով, և որ թույլատրվում են միայն որոշակի շառավղներով ուղեծրեր։ Միջուկին ամենամոտ ուղեծիրը ներկայացնում էր ատոմի հիմնական վիճակը և ամենակայունն էր. Ավելի հեռու ուղեծրերը ավելի բարձր էներգիայով գրգռված վիճակներ էին
