
- Հեղինակ Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Վերջին փոփոխված 2025-01-22 17:00.
Այսպիսով, մենք հաշվարկել այն վերցնելով կշռվածը զանգվածային իզոտոպներից յուրաքանչյուրը և դրանք միասին ավելացնելով: Այսպիսով, առաջինի համար զանգվածային , մենք կբազմապատկենք 84-ի 0,50%-ը (ամու - ատոմային զանգված միավորներ) = 0,042 ամու, և ավելացրեք այն 86 ամու = 8,51 ամու 9,9%-ին և այլն:
Հետագայում կարելի է նաև հարցնել՝ ինչպե՞ս եք հաշվարկում ատոմային միջին զանգվածը։
Միջին ատոմային զանգվածի հաշվարկ Այն միջին ատոմային զանգված տարրի գումարն է զանգվածները իր իզոտոպներից յուրաքանչյուրը բազմապատկած իր բնական առատությամբ (տասնորդականը՝ կապված տոկոսի հետ ատոմներ այդ տարրի, որոնք տվյալ իզոտոպից են): Միջին ատոմային զանգված = զ1Մ1 + զ2Մ2 +…
Նաև գիտեք, թե ինչ երեք տեսակի տեղեկատվություն է անհրաժեշտ միջին ատոմային զանգվածը հաշվարկելու համար: Տարրի համար գոյություն ունեցող իզոտոպների թիվը: Այն Ատոմային Համարը տարրի համար: Յուրաքանչյուր իզոտոպի տոկոսային առատությունը:
Կարելի է նաև հարցնել՝ ո՞ր արժեքն է ամենամոտը ստրոնցիումի ատոմային զանգվածին։
Ստրոնցիում . Հանձնաժողովն իր 1961 թվականի զեկույցում առաջարկել է Աr(Sr) = 87.62 հիման վրա զանգվածային - Նիերի սպեկտրաչափական որոշումը: Սա արժեքը վերանայվել է Աr(Sr) = 87.62 (1) 1969 թվականին և այն մնում է անփոփոխ:
Որքա՞ն է 1 ամու զանգվածը:
Ատոմային զանգվածի միավորը (խորհրդանշվում է AMU կամ amu) սահմանվում է որպես ածխածնի 12 ատոմի զանգվածի ճշգրիտ 1/12: Ածխածնի-12 (C-12) ատոմն ունի վեց պրոտոններ և վեց նեյտրոններ իր միջուկում։ Անճշգրիտ առումով, մեկ AMU-ն միջինն է պրոտոն հանգստի զանգվածը և նեյտրոն հանգստի զանգված.
Խորհուրդ ենք տալիս:
Որքա՞ն է ատոմի միջին ատոմային զանգվածը:

Տարրի միջին ատոմային զանգվածը նրա իզոտոպների զանգվածների գումարն է, որոնցից յուրաքանչյուրը բազմապատկվում է իր բնական առատությամբ (տասնորդական թիվը՝ կապված տվյալ տարրի ատոմների տոկոսի հետ, որոնք տվյալ իզոտոպից են)։ Միջին ատոմային զանգված = f1M1 + f2M2 +
Ինչպե՞ս է որոշվում պարբերական աղյուսակում ներկայացված միջին ատոմային զանգվածը:

Տարրի միջին ատոմային զանգվածը հաշվարկվում է՝ գումարելով տարրի իզոտոպների զանգվածները, որոնցից յուրաքանչյուրը բազմապատկվում է Երկրի վրա իր բնական առատությամբ: Տարրերի կամ միացությունների հետ կապված զանգվածի հաշվարկներ կատարելիս միշտ օգտագործեք միջին ատոմային զանգվածը, որը կարելի է գտնել պարբերական աղյուսակում։
Ինչպե՞ս եք հաշվարկում բորի ատոմային զանգվածը:
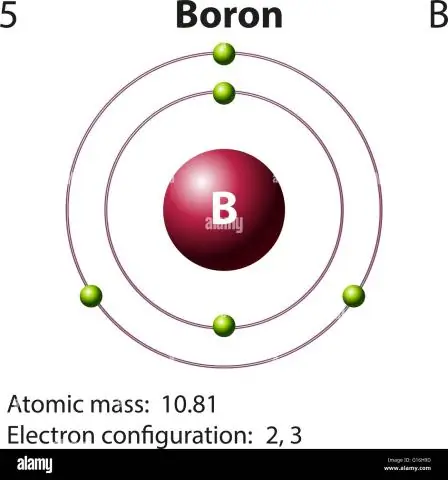
Բորի համար այս հավասարումը կունենա հետևյալ տեսքը. 5 պրոտոն + 5 նեյտրոն = 10 ատոմային զանգվածի միավոր (AMU) կամ ավելի հաճախ հանդիպող բորի իզոտոպի համար (մոտ 5 պրոտոն + 6 նեյտրոն = 11 AMU):
Ինչպե՞ս եք հաշվարկում ատոմային զանգվածի պրակտիկայի խնդիրները:

ՏԵՍԱՆՅՈՒԹ Հետո ինչպե՞ս եք լուծում ատոմային զանգվածի խնդիրները: Դեպի հաշվարկել որ ատոմային զանգված տարրի մեկ ատոմից, գումարեք զանգվածային պրոտոնների և նեյտրոնների. Օրինակ՝ Գտեք ատոմային զանգված ածխածնի իզոտոպ, որն ունի 7 նեյտրոն։ Պարբերական աղյուսակից կարելի է տեսնել, որ ածխածինը ունի ան ատոմային 6 թիվը, որը նրա պրոտոնների թիվն է։ Բացի այդ, ո՞րն է ատոմային զանգվածային թիվը:
Ինչպե՞ս եք հաշվարկում ատոմային տնտեսությունը:
Ատոմային տնտեսությունը հաշվարկելու համար շարունակելու ընդհանուր ձևը հետևյալ քայլերն է. Կառուցեք քիմիական հավասարում տվյալ ռեակցիայի համար: Հավասարակշռեք հավասարումը. Հաշվե՛ք ռեակտիվ նյութերի և արտադրանքների զանգվածները՝ օգտագործելով ատոմային զանգվածները և բանաձևի զանգվածները պարբերական համակարգից: Հաշվեք ատոմային տնտեսության տոկոսը
